La recherche d’une énergie durable représente aujourd’hui un défi majeur pour notre société. Pour faire face à une demande énergétique en constante augmentation sans pour autant nuire au climat mondial, des scientifiques ont recours à des processus naturels qui, depuis des milliards d’années, fournissent aux plantes et à de nombreuses formes animales leur source d’énergie. Leur secret est la conversion de l’énergie lumineuse en énergie chimique dans le processus de la photosynthèse.
Dans une nouvelle étude publiée dans le Journal “the American Chemical Society”, Christine Lewis et ses collègues de l’ASU décrivent un dispositif hybride breveté, mélangeant à la fois organisme vivant et batterie biologique, capable de produire de l’énergie stockée en augmentant le flux d’énergie dans des conditions de lumière où la photosynthèse naturelle est normalement inhibée.
Cette technologie ouvre une voie verte pour la production d’une large gamme de produits utiles, incluant les carburants , les produits agrochimiques, les produits thérapeutiques, les cosmétiques, les plastiques et les produits chimiques spécialisés ainsi que des dérivés pour les humains et les animaux.
L’étude montre que des microbes photosynthétiques modifiés – dans ce cas, des cyanobactéries – peuvent recevoir des électrons d’une source externe et les utiliser pour alimenter des réactions chimiques qui pourraient éventuellement être exploitées pour des applications humaines. Les chercheurs appellent cette approche l’électro photosynthèse microbienne ou MEPS.
“Ce projet consiste à percer les mystères liés au transfert d’énergie. Plus précisément, nous nous efforçons de faire le lien entre l’énergie artificielle et la photosynthèse naturelle en exploitant la dernière moitié de la chaîne de transport des électrons de la photosynthèse”, explique M. Lewis. “Les objectifs de la recherche sont d’avoir la capacité d’activer la photosynthèse à volonté, de la rendre éventuellement plus efficace et de produire des produits énergétiques stables.”
Mme Lewis est chercheuse au Biodesign Center for Applied Structural Discovery (CASD), au Swette Center for Environmental Biotechnology (EB) et à la School of Molecular Sciences (SMS) de l’ASU.
Elle est accompagnée de ses collègues de l’ASU, Petra Fromme, directrice du Center for Applied Structural Discovery, Bruce Rittmann, directeur du Swette Center for Environmental Biotechnology et professeur à la School of Sustainable Engineering and the Built Environment de l’ASU , Wim Vermaas, de l’école des sciences de la vie de l’ASU et de l’Institut mondial de durabilité Julie Ann Wrigley (GIS) ; Cesar Torres, de l’EB et de l’école d’ingénierie de la matière, du transport et de l’énergie de l’ASU ; Justin Flory, directeur associé de l’Engineering Center for Negative Carbon Emissions et Thomas et Anna Moore, du GIS, du SMS et du CASD.
Photosynthèse 2.0
La recette de base de la photosynthèse naturelle ne comporte que quelques ingrédients clés : de l’eau, de la lumière solaire et du CO2. Les cellules photosynthétiques agissent comme de minuscules usines pour la production de glucose, qui est ensuite converti en ATP, la principale devise énergétique de la cellule. Au cours du processus, l’oxygène est produit en tant que sous-produit respiratoire, mais il peut s’avérer dangereux pour le processus de photosynthèse lorsque des espèces radicalaires d’oxygène nuisibles sont produites par une lumière de haute intensité.
Bien que la photosynthèse soit parfaitement adaptée à la satisfaction des besoins énergétiques des plantes et d’autres organismes photosynthétiques, la vitesse à laquelle la lumière est convertie en énergie chimique utile est bien trop faible pour permettre de répondre aux besoins énergétiques de l’homme d’aujourd’hui. Les chercheurs cherchent depuis longtemps des moyens d’exploiter la photosynthèse naturelle tout en l’améliorant pour trouver des solutions énergétiques neutres en carbone.

Un partenariat avec la nature
Il existe plusieurs facteurs limitatifs importants en termes d’efficacité de conversion énergétique dans la photosynthèse naturelle. Premièrement, les organismes photosynthétiques n’utilisent qu’une petite partie du spectre de la lumière émise par le soleil, à savoir la lumière rouge visible. Deuxièmement, le taux de fixation du carbone est trop lent pour des applications pratiques. Pour l’augmenter, il faut augmenter le taux d’électrons se déplaçant dans la chaîne de transport.
Enfin, les organismes photosynthétiques ne peuvent traiter qu’une quantité limitée d’électrons. Si la chaîne de transport des électrons est alimentée par une trop grande quantité d’électrons à la fois, le processus peut s’arrêter à cause de la lumière, ce qui désactive ou tue la cellule. Cette limitation de l’efficacité énergétique est principalement due à un composant clé de la machinerie de transport d’électrons de la cellule, un complexe protéique connu sous le nom de photosystème II (PS II).
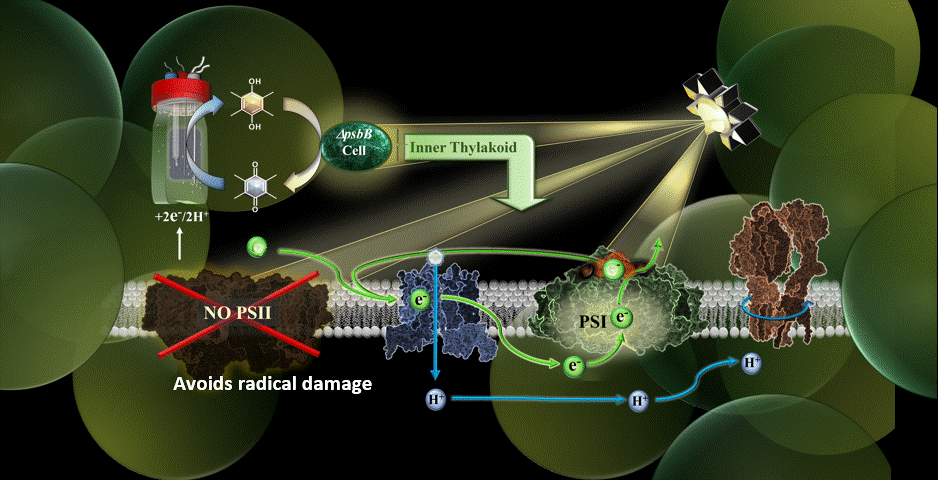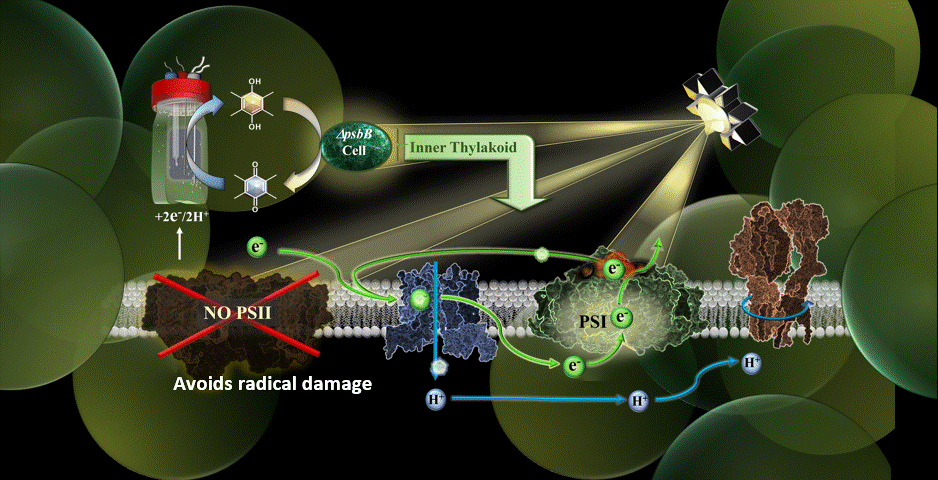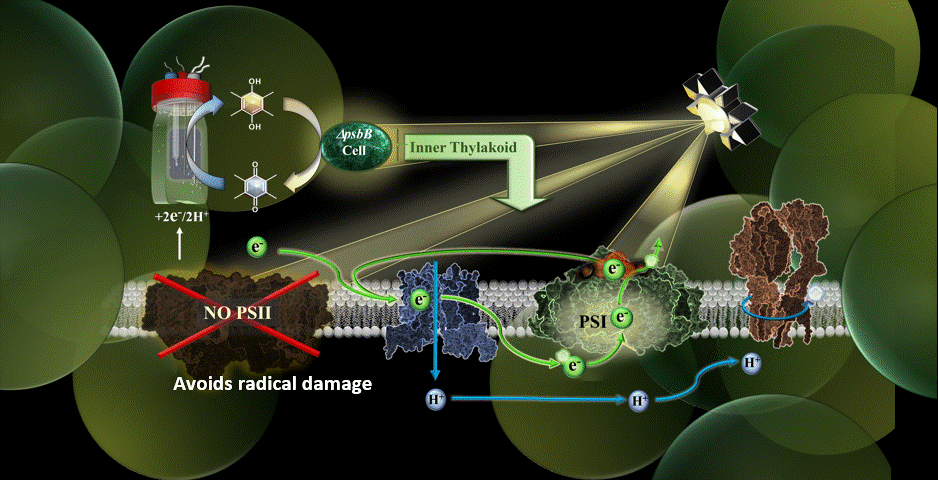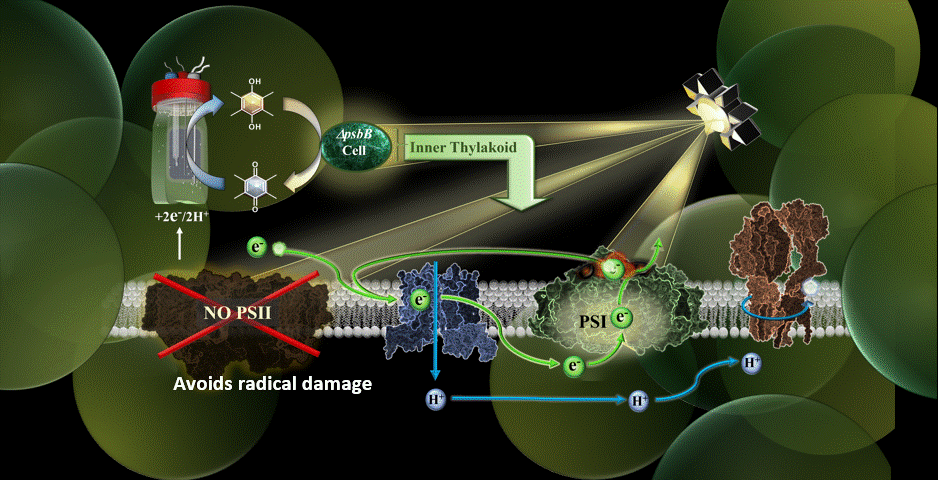
Dans la nouvelle étude, le système MEPS est représenté par une cyanobactérie génétiquement modifiée reliée à une cathode externe. Les cyanobactéries utilisées ont été remodelées dans le laboratoire du co-auteur Wim Vermaas pour effectuer le cycle photosynthétique des électrons sans le composant du photosystème II.
Grâce à des médiateurs chimiques, les électrons sont transférés de la cathode du dispositif à la chaîne de transport d’électrons de la cyanobactérie. Le photosystème II, vulnérable à la lumière, ayant été éliminé, le processus de photosynthèse s’effectue par une autre voie, à savoir par le photosystème I.
Les résultats ont confirmé la possibilité de réaliser la photosynthèse en utilisant un apport externe d’électrons pour alimenter la chaîne de transport d’électrons, et ce en présence d’une lumière de très haute intensité.
“L’une de mes priorités au sein de l’équipe était de trouver le bon médiateur électrochimique pour faire entrer les électrons dans la cellule”, a déclaré Torres. “Je pense que le point culminant a été de réaliser que nous avons atténué certaines des plus grandes limitations de Synechocystis (cyanobactéries) en retirant le photosystème II pour le système et en leur donnant des électrons à partir d’une électrode.”
Un avenir durable
Le système MEPS pourrait utiliser les cellules solaires actuellement disponibles pour fournir les électrons externes nécessaires aux réactions photosynthétiques. Les cellules photovoltaïques pourraient fournir des électrons à partir de longueurs d’onde allant de zéro à des milliers de nanomètres, offrant ainsi un spectre beaucoup plus large pour la récolte de la lumière que celui habituellement disponible pour la photosynthèse naturelle.
Le projet, qui a nécessité six années de travail, est le fruit d’un melting-pot de disciplines scientifiques, dont la microbiologie, l’ingénierie, la biochimie, l’électrochimie, la photochimie et la physique. Il a provoqué un engouement important suite aux présentations de Mme Lewis lors de diverses conférences, et ses recherches ont été récompensées par plusieurs prix importants, notamment le prix de la meilleure présentation orale de la North American International Society of Electrochemical Microbes Conference en 2021, le prix de la meilleure affiche de la Eastern Regional Photosynthetic Conference en 2021, le prix de l’énergie de la Nature Conference en 2019, le prix de la Gordon Research Conference en 2019 et le prix Madame Curie en 2018 lors de la retraite Fusion de Biodesign.
“D’ici 2050, si l’expansion mondiale se poursuit au rythme où elle va, nos besoins énergétiques dépasseront notre offre. Toutefois, il est possible d’agir dès maintenant afin de trouver des solutions permettant de fournir une énergie plus efficace et plus propre”, explique M. Lewis. “Mon objectif est de contribuer à la prochaine “percée” qui aidera à faire de cette grande bille bleue un endroit meilleur.”
Sources:
Documentation fournie par l’Arizona State University. Texte original écrit par Richard Harth